1. Berikut yang termasuk molekul unsur adalah….
a. H2O
b. O2
c. CO2
d. CO
e. SO2
2. Lambang suatu unsur 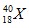 dapat disimpulkan bahwa pada satu atom unsur X mempunyai. . .
dapat disimpulkan bahwa pada satu atom unsur X mempunyai. . . A. 18 neutron dan 18 proton
B. 22 neutron dan 22 proton
C. 40 proton dan 18 elektron
D. 18 proton dan 22 neutron
E. 18 neutron, 22 proton, dan 22 elektron
CHAPTER 3
1. Berapa gram massa Ca dari 6 mol........ (Ar Ca = 40 ) ?
a. 260 gram
b. 250 gram
c. 240 gram
d. 230 gram
e. 220 gram
2. Jika di dalam senyawa FeS perbandingan massa Fe : S = 7:4 , maka untuk menghasilkan 4,4 gram senyawa FeS diperlukan Fe dan S berturut-turut sebanyak . . . . .
a. 4,0 gram dan 0,4 gram
b. 3,7 gram dan 0,7 gram
c. 2,8 gram dan 1,6 gram
d. 3,0 gram dan 1,4 gram
e. 3,2 gram dan 1,2 gram
CHAPTER 4
1. Kertas lakmus biru akan berubah menjadi merah, bila dimasukkan ke dalam larutan…
a. Kalium hidroksida
b. Natrium klorida
c. Barium sulfat
d. Asam klorida
e. Natrium nitrat
2. Nilai bilangan oksidasi dari Cl2 didalam Ca(ClO2)2 adalah . . .
a. 16
b. 6
c. 1
d. 4
e. 12
CHAPTER 5
1. Sebuah tangki selam mengandung udara dengan temperatur . Tangki selam berbentuk silinder dan memiliki volume sebesar . Berapa besar tekanan udara di dalam tangki tersebut.(diketahui besar konstanta gas R = 8,3 J/mol . K)
a. 10 MPa
b. 20 MPa
c. 30 MPa
d. 40 MPa
2. Aini sedang mengadakan sebuah pesta ulang tahun dan menginginkan sebuah ruangan agar diisi dengan sebuah balon helium yang besar. Temperatur ruangan sebesar 24o Celcius. Balon diisi dengan gas helium dan memiliki volume sebesar 0,24 m3 serta tekanan didalamnya sebesar 0,038 atm. Berapa besar tekanan akhir balon besar tersebut hingga menempati ruangan sebesar 0,4 m3?
a. 0,0038 atm
b. 0.0053 atm
c. 0,0034 atm
d. 0,0028 atm
CHAPTER 6
1. Entalpi pembakaran asetilena adalah -1300 kJ, entalpi pembentukan asetilena, C2H2 adalah….
(ΔHf° CO2 = -395 ; ΔHf° H2O = -285 )
a. -225 kJ
b. +225 kJ
c. -450 kJ
d. +450 kJ
e. -620 kJ
2. Pada suatu percobaan, 3 L air dipanaskan sehingga suhu air naik dari 25° C menjadi 72°C Jika diketahui massa jenis air = 1g mL‾¹, dan kalor jenis air = 4,2 J/g K, Hasil ∆H reaksi pemanasan tersebut adalah.…
a. 592,2 kJ
b. 5922 kJ
c. 59,22 kJ
d. 5,922 kJ
e. 59220 kJ
CHAPTER 7
1. Ion X2- memiliki konfigurasi elektron terluar adalah 3s2 3p4, maka nomor atom unsur X adalah..
A. 16
B. 18
C. 20
D. 14
E. 19
2. Argon mempunyai nomor atom 18. Ion berikut yang mempunyai konfigurasi
elektron [Ar] 3d4 adalah..
A. 20Ca2+
B. 22Ti2+
C. 24Cr2+
D. 25Mn2+
E. 26Fe2+
CHAPTER 8
1. Letak unsur X dengan nomor atom 26 dan nomor massa 56 dalam sistem periodik unsur terletak pada golongan dan periode…
A. IIA dan 6
B. VIB dan 3
C. VIB dan 4
D. VIIIB dan 3
E. VIIIB dan 4
2. Konfigurasi elektron dari unsur P adalah… (nomor atom Ne = 10, Ar = 18)
A. [Ne] 3s¹
B. [Ne] 4s¹
C. [Ar] 3s¹
D. [Ar] 4s¹
E. [Ar] 4s² 3d¹
CHAPTER 9
1. Di antara senyawa berikut yang bukan molekul kovalen polar adalah …
A. HCL
B. NaCl
C. NH3
D. H2O
E. PCl3
2. Diantara pasangan atom berikut ini, manakah yang dapat membentuk senyawa dengan ikatan ionik.
a. Ca dan Ni
b. Cu dan Ar
c. F dan S
d. Zn dan K
e. Na dan Cl
CHAPTER 10
1. Berapakah besar sudut ikatan pada molekul H2S ?
a. 45,2°
b. 60,3°
c. 92,1°
d. 110,4°
e. 120,1°
2. Berapakah besar sudut ikatan yang dibentuk pada molekul BeF2
a. 45°
b. 60°
c. 90°
d. 110°
e. 180°
CHAPTER 11
1. Tegangan permukaan zat cair adalah............
a. Kecendrungan permukaan zat cair untuk memuai, sehingga permukaannya menjadi tegang
b. Kecendrungan permukaan zat cair untuk menegang, sehingga permukaannya seperti ditutupi oleh suatu lapisan elastis
c. Kecendrungan permukaan zat cair untuk ditutupi lapisan tipis
d. Kecendrungan zat cair untuk menegang yang diakibatkan adanya kohesi antara zaat cair dengan udara
e. Kecendrungan zat cair untuk menegang akibat adanya adhesi zat cair
2. Apa yang menyebabkan terjadinya gaya dipol- dipol saat HCL dilarutkan di dalam air ?
a. Terdapat gaya tarik atom O dari air dengan atom Cl dari HCl
b. Terdapat gaya tarik atom H dari air dengan atom H dari HCl
c. Terdapat gaya tarik atom H dari air dengan atom Cl dari HCl
d. Terdapat gaya tarik atom H dari air dengan atom H dari air
e. Terdapat gaya tarik dari atom Cl dari HCl dengan atom Cl dari HCl
CHAPTER 12
1. Salah satu yang akan di sebabkan oleh keberadaan zat terlarut dalam pelarut adalah ….
a. Tekanan uap jenuh lebih tinggi daripada tekanan uap jenuh pelarut
b. Titik beku larutan lebih tinggi daripada titik beku pelarut
c. Tekanan osmosis larutan lebih rendah dari tekanan osmosis pelarut
d. Titik didih larutan lebih tinggi daripada titik didih pelarut
e. Titik didih pelarut lebih tinggi dari pelarutnya
2. Sifat – sifat berikut menunjukan sifat koloid, kecuali …
a. Dapat lolos dari kertas saring
b. Menghamburkan berkas cahaya
c. Dapat mengabsorbsi
d. Menunjukan gerak brown
e. Dapat bersifat hidrofob atau hidrof


Tidak ada komentar:
Posting Komentar